PD-L1免疫药物Imfinzi获批用于Ⅲ期非小细胞肺癌(NSCLC)治疗
編輯:香港特區腫瘤中心 來源:香港特區腫瘤中心 發佈時間:2018-02-26
2018農曆春節,美國FDA以一種特殊的方式恭賀新禧,尤其是對於肺癌患者來說,更是難得的喜事。阿斯利康(AstraZeneca)的PD-L1抑制劑Imfinzi(durvalumab)獲美國FDA批准用於治療無法手術切除、但病情在現有放化療的治療下沒有出現進展的Ⅲ期非小細胞肺癌(NSCLC)患者。這是針對此類患者群體中第一個被批准用於降低放化療後癌症進展風險的治療方案。

肺癌是我國發病率和死亡率增長最快,對人群健康和生命威脅最大的惡性腫瘤之一。近50年來許多國家都報導肺癌的發病率和死亡率均明顯增高,男性肺癌發病率和死亡率均占所有惡性腫瘤的第一位,女性發病率占第二位,死亡率占第二位。
其中非小細胞肺癌占所有肺癌的80%以上。對於手術無法切除的NSCLC,培美曲賽+卡鉑+貝伐單抗成為肺腺癌類型患者的標準一線化療,精准放療的優化對部分患者也可以達到與手術比肩的效果。但如果此類疾病抵達Ⅲ期,就意味著腫瘤已經擴散到了附近的淋巴結,或是肺部附近的其他部位。這些患者的預後並不樂觀,病情隨時有惡化的風險。
此次PD-L1免疫藥物Imfinzi獲批用於Ⅲ期不可切除的非小細胞肺癌治療方案,是基於一項713名Ⅲ期NSCLC患者參加的PACIFIC臨床試驗。與安慰劑對照組相比,Durvalumab治療組使中位無進展生存期(PFS)提高了11.2個月(治療組16.8:對照組5.6個月),風險降低48%,而與PD-L1狀態無關。12個月PFS率治療組為55.9%,而對照組為35.3%,18個月PFS率治療組為44.2%,而對照組為27.0%。
基於這些公開的良好資料,美國FDA批准用於此類NSCLC患者,用於降低放化療後癌症進展的風險。值得一提的是,這良好資料也曾讓Imfinzi在該適應症上獲得過突破性療法認定與優先審評資格。此外,另一項關鍵資料總生存期(OS)正在統計中,將在未來公佈。
“針對罹患Ⅲ期NSCLC、腫瘤無法切除且在放化療後沒有進展的患者,這是首款用於降低他們癌症進展風險的療法,”FDA藥物評估與研究中心血液學和腫瘤學產品辦公室代理主任兼FDA腫瘤卓越中心主任RichardPazdur博士說道:“對於無法切除的Ⅲ期NSCLC患者,目前只有通過放化療來預防腫瘤進展。儘管少量患者可能得到很好的治療,但隨時可能出現進展或轉移。現在,患者們有了一款全新的獲批療法,能在放化療後,更長時間地防止癌症出現進展。”
我們祝賀阿斯利康的這款新藥獲批擴大適應症,也期待它能為廣大肺癌患者帶來福音。
關於Durvalumab
作為一種針對PD-L1蛋白的單克隆抗體,Durvalumab能夠結合腫瘤表面表達的PD-L1蛋白,抑制它們與T細胞表面的PD-1蛋白結合。因此,腫瘤細胞就無法利用PD-L1/PD-1途徑來逃避免疫系統的追殺啟動免疫系統殺傷腫瘤的效果。
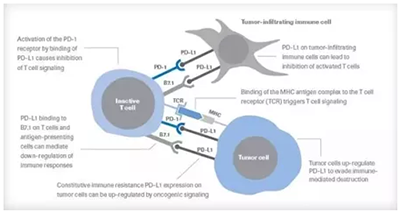
▲PD-L1/PD-1通路原理介紹
更讓人驚喜的是,Durvalumab的副作用更小,最常見不良反應包括:疲勞、肌肉骨骼痛、便秘、食欲下降、噁心、外周性水腫和尿路感染,均為患者可以承受範圍。因此,對於PD-L1表達的腫瘤患者,不失為一種好的選擇。
Durvalumab效果究竟有多好
Durvalumab獲美國FDA加速批准,是基於在一項有182名患者參與的臨床試驗中,Durvalumab的療效得到確認基礎上的。182名罹患晚期或轉移性尿路上皮癌的患者先前接受了鉑類化療,但病情依舊出現了進展。臨床實驗中,每兩周,這些患者接受10mg/kg Durvalumab靜脈滴注。

獨立的評審小組發現,患者的客觀緩解率達到了17%。而在PD-L1高度表達的95名患者中,客觀緩解率更是達到了26.3%。這對相當不樂觀的晚期尿路上皮癌患者來說實在是太驚喜了!
更多關於Durvalumab的臨床試驗正在進行
除了獲批于尿路上皮癌和Ⅲ非小細胞肺癌的治療,PD-L1抗體Durvalumab更多的臨床試驗正在進行中,我們期待Durvalumab能獲批用於頭頸癌、胃癌、肝癌和血液腫瘤等疾病的治療。

