重磅:史上首個諾華CAR-T細胞藥物獲FDA批准上市
編輯:香港特區腫瘤中心 來源:u. s. food & drug 發佈時間:2017-08-31
2017年8月30日,醫藥行業迎來一條重磅新聞,諾華的基因治療方法CAR-T細胞藥物 Kymriah(tisagenlecleucel,CTL-019)被美國FDA批准上市,用於治療兒童和年輕成人(2~25歲)的急性淋巴細胞白血病(ALL)。這是醫學史上首款批准的CAR-T療法,也是在美國境內,首次獲批的基因療法。諾華將Kymriah的價格定為治療一次47.5萬美元。
急性淋巴細胞白血病(ALL)是一種起源於淋巴細胞的B系或T系細胞在骨髓內異常增生的惡性腫瘤性疾病。原始細胞可在骨髓聚集並抑制正常造血功能,造成周邊血管、骨髓、全身淋巴結、脾臟與肝臟的浸潤,並在這些部位繼續生長和分化。它們可以刺激腦脊髓膜,導致炎症(腦膜炎),貧血,肝臟和腎臟衰竭以及其他器官損害。ALL可發生於任何年齡,它是兒童最常見的惡性腫瘤,占15歲以下兒童所有惡性腫瘤的25%。ALL最常見於2~5歲之間的幼兒。對於成人來說,45歲以上更為多見。
近日獲批的 Kymriah正是一款為這些患者帶來福音的突破性治療方法。CAR-T療法(Chimeric Antigen Receptor T-Cell immunotherapy)全稱嵌合抗原受體T細胞免疫療法,其原理是將病人體內取得的T細胞,用基因工程的方法經啟動、轉染、修飾、擴增後,重新注射到病人體內,通過激發人體自身的免疫系統來消滅腫瘤。由於CAR-T克服了主要組織相容性複合體(MHC)的限制性,可更有效的殺傷抗原特異性的腫瘤細胞,減少了由於腫瘤降低MHC分子表達而造成的免疫逃逸,同時具備抗原抗體結合特異性好、親和力高的優勢。此外,由於打破病人對於MHC的限制後,CAR改造的T細胞相對于天然T細胞表面受體TCR能治別更廣泛的目標。
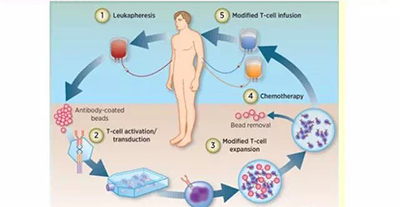
CAR-T細胞治療具體來看主要分為5個步驟:
1. 從癌症患者外周血中分離出T細胞;
2. T細胞啟動,利用基因工程將能特意識別腫瘤細胞的CAR結構轉入T細胞;
3. 體外培養,大量擴增CAR-T細胞至治療所需劑量,一般為十億至百億級別;
4. 化療清淋預處理;
5. 回輸CAR-T細胞,觀察療效病嚴密監測不良反應。
Kymriah的安全性與療效在一個多中心的臨床試驗中得到了驗證。這個臨床試驗招募了63名罹患難治性或復發性B細胞前體ALL的兒童和青年。在治療的3個月內,CAR-T療法帶來的總體緩解率達到了83%。但同時,使用Kymriah有潛在的嚴重副作用,可能會產生細胞因數釋放綜合症(CRS)、神經毒性、脫靶效應等毒副作用。CRS和神經系統事件都可能危及生命。Kymriah的其他嚴重副作用還包括嚴重感染、低血壓、急性腎損傷,大多數症狀出現在輸入Kymriah後1-22天。
同時,FDA擴大了Actemra(托西珠單抗)的批准,以治療2歲以上患者因CAR-T細胞誘導的嚴重或危及生命的CRS副反應。在用CAR-T細胞治療的患者的臨床試驗中,69%的患者CRS在一個或兩個劑量的Actemra後兩周內完全消除。
現任美國FDA局長的Scott Gottlieb博士說道:“基因和細胞療法等創新科技具有變革醫學的潛力,也能讓我們在棘手疾病的治療上迎來轉捩點,讓我們有望治療,甚至是治癒這些疾病。FDA致力於説明加速有望拯救生命的革命性療法的開發於審評。”
“5年前,我們開始與賓夕法尼亞大學(Universityof Pennsylvania)合作,投資並進一步開發我們認為足以改變癌症治療範式的免疫細胞療法。今日Kymriah的獲批,也再次體現我了我們改變癌症治療的承諾”諾華首席執行官Joseph Jimenez先生評論到。
作為腫瘤免疫治療的主要手段之一,CAR-T細胞治療在白血病、淋巴瘤、多發性骨髓瘤的治療中展現出驚豔的治療效果,2017年可謂是CAR-T療法的元年,我們見證了歷史上首款CAR-T療法藥物的問世,一個波瀾壯闊的細胞療法時代已經來臨,我們期待為那些原本無藥可治的患者,帶去全新的生命曙光。

